Variazioni dell’HRV in acuto su pazienti sottoposti a terapia manuale fisioterapica
- Mosè Mondonico
- 21 nov 2022
- Tempo di lettura: 11 min
Mondonico Mosè1; Viti Antonio2; Garfagnini Susanna2
1 ISEC Innovative Science Exercise Core
2 Centro Fisioterapico Apuano
Questo scritto fa parte di una serie di progetti di ricerca volti a valutare le variazioni in acuto del sistema nervoso centrale in seguito a trattamenti fisioterapici. Una parte di questi sono in pubblicazione con l'università degli studi di Firenze. La ricerca seguente invece non è stata selezionata per la pubblicazione per delle difficoltà sulla standardizzazione dei protocolli fisioterapici ma abbiamo fatto tutta l'analisi statistica ed i risultati sono interessanti.
SCOPO
L'utilizzo della variabilità della frequenza cardiaca HRV è stata a lungo utilizzata come strumento affidabile per misurare e conseguentemente valutare lo stato di attività del sistema nervoso centrale. Ma mentre la maggior parte degli studi si è concentrata sulla valutazione dell'HRV in uno stato di riposo, si sa poco del potenziale di questa indagine sui soggetti sottoposti a trattamento terapeutico.
Se dovessimo sintetizzare cosa è la variabilità della frequenza cardiaca dovremmo prima di tutto dire: un solo parametro, molti indici.
La variazione in termini tempo fra i battiti è una rappresentazione della funzionalità del nostro sistema nervoso (Bertson G. et al. 1997).
L'attitudine dell'individuo a bilanciare l'azione del sistema nervoso autonomo ha delle concrete influenze sul sistema cardio-respiratorio e conseguentemente sul ritmo cardiaco. Il cuore, infatti, non è un metronomo e i suoi battiti non hanno la regolarità di un orologio; pertanto, la variabilità della frequenza cardiaca è fisiologica ed indica il grado di adattabilità psico-fisica dell'individuo in risposta ai diversi fattori, quali respirazione, esercizio fisico, stress mentale, ansia, rabbia, cambiamenti emodinamici e metabolici, ortostatismo, patologie etc.
La misura della variabilità della frequenza cardiaca è quindi la misura dell’efficienza o dello stato di stress del nostro sistema nervoso.
La variabilità dell'intervallo R-R è il parametro indagato nella tecnica di misurazione della HRV.
La HRV può essere valutata fondamentalmente utilizzando tre diverse chiavi di lettura: nel dominio del tempo, calcolando un indice mediante operazioni statistiche sull'intervallo R-R; nel dominio delle frequenze, come analisi della densità spettrale di potenza (PSD) e per finire analizzando i dati non lineari. Tutte le misure si ottengono a partire da registrazioni del segnale R-R della durata di circa 5 minuti (Nunan et al. 2010) .
L’approccio basato sul dominio del tempo vede 4 misure differenti.
RMMSD: Differenza quadratica media fra gli intervalli R-R adiacenti. Riflette la varianza a breve termine della F.C. ed è collegata all’attivazione parasimpatica (De Giorgio C. et al. 2010).
SDNN: Deviazione standard totale. Riflette tutte le componenti compresi i ritmi circadiani dell’HRV (Tsuji et al. 1996).
PNN50: Percentuale di intervalli NN adiacenti che differiscono tra loro più di 50 ms. Strettamente correlato con l'attività del parasimpatico. Maggiore è la percentuale, maggiore è la variabilità, migliore lo stato del soggetto
NN50: Numero di intervalli NN di battiti adiacenti che differiscono l'uno dall'altro di oltre 50 ms
L’approccio nel dominio della frequenza si basa sull’identificazione e quantificazione (in termini di frequenza e potenza) dei principali ritmi oscillatori di origine fisiologica di cui si compone una sequenza di intervalli R-R. L'analisi spettrale implica la decomposizione delle sequenze degli intervalli R-R in una somma di funzioni sinusoidali di diverse ampiezze e frequenze attraverso l'algoritmo della trasformata di Fourier.
I risultati possono essere visualizzati come ampiezza della variabilità in funzione della frequenza attraverso lo spettro di potenza, indicativo della potenza delle frequenze comprese fra 0.01 e 0.4 Hz. Gli studi e le ricerche degli ultimi anni, hanno permesso di distinguere tre sotto-bande di frequenze, chiamate rispettivamente (Beckers F. et al 2001):
1. VLF (Very Low Frequency) frequenze comprese fra 0.01 e 0.04 Hz. Sono correlate a vari meccanismi lenti del sistema simpatico, dai cambiamenti nella termoregolazione e, in ambito psicologico, dalle preoccupazioni e dai pensieri ossessivi.
2. LF (Low Frequency) frequenze comprese fra 0.04 e 0.15 Hz. La banda delle LF viene considerata principalmente correlata all'attività del Sistema Nervoso Simpatico.
3. HF (High Frequency) frequenze comprese fra 0.15 e 0.4 Hz. La banda delle HF viene considerata espressione dell'attività del Sistema Nervoso Parasimpatico.
Il rapporto tra basse ed alte frequenze (LF/HF) è un parametro di fondamentale importanza perchè permette di quantificare l'equilibrio tra i due sistemi simpatico e parasimpatico: un valore alto indica la predominanza del sistema simpatico, mentre un rapporto minore di 1 corrisponde ad una prevalenza dell’attività vagale (parasimpatico).
Per ultimi abbiamo i parametri non lineari, SD1 Indica la deviazione standard dei punti perpendicolari alla linea di identità, correlato alla variabilità a breve termine influenzata dall'aritmia del sistema respiratorio e correlato la sensibilità del riflesso barocettoriale; SD2 è la deviazione standard lungo la linea di identità, misura la variabilità a breve e lungo termine (M. Brennan et al. 2001).
In questo studio abbiamo voluto valutare in acuto su pazienti, l’effetto della terapia manuale fisioterapica sul sistema nervoso centrale mediante l’analisi dei parametri tipici dell’HRV, ovvero i parametri relativi al dominio del tempo (SDNN, RMSSD, PNN50 e NN50), quelli relativi al dominio della frequenza (VLF, LF, HF, LF/HF) e per ultimo quello dei parametri non lineari (SD1 e SD2). Abbiamo inoltre tenuto conto della frequenza cardiaca FC. Lo scopo principale è quello di valutare se la terapia manuale ha un effetto significativo sulle modificazioni dell’HRV.
L’assunto di partenza è quello di verificare se la terapia manuale avesse qualche effetto in relazione alle risposte del sistema nervoso centrale.
METODI
Sono stati valutati 75 pazienti di un centro fisioterapico suddivisi fra maschi n43 e femmine n31, in questo studio non era nostra intenzione verificare se ci fossero differenze legate al sesso o all’età. Tutti i partecipanti hanno firmato il consenso informato.
Prima della terapia fisioterapica, i pazienti sono stati monitorati in ambulatorio da seduti, mediante una fascia cardiaca Polar H7 (Polar Electro, Kempele Finland) sono stati rilevati i parametri dell’HRV per 5 minuti (Malik M. et al. 1996). Successivamente i pazienti venivano inviati dal fisioterapista per l’esecuzione di un ciclo di terapia manuale di 45 minuti. La terapia manuale era incentrata sull’utilizzo di tecniche che potevano prevedere la mobilizzazione di tessuti ossei, capsulari, legamentosi, tendinei, muscolari e fasciali, in relazione alla patologia di ingresso del paziente.
Finita la terapia i pazienti avevano a disposizione 10 minuti di tempo libero, prima di venire rivalutati in ambulatorio sempre per 5 minuti, da seduti con la fascia cardiaca.
I dati relativi all’HRV sono stati successivamente valutati con il software per desktop Kubios HRV Premium 3.4.1 (Kubios OY, Kuopio, Finland)
L’analisi statistica prevedeva di valutare la correlazione fra i parametri pre e post e la significatività calcolata con l’ANOVA.
RESULTATI
La frequenza cardiaca di base ha subito una diminuzione del 7% passando da una media di 75 bpm a 70 bpm con un’elevata correlazione r0,89 e raggiungendo la significatività statistica p0,01 (Fig 1).

Figura 1
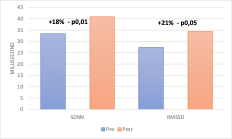
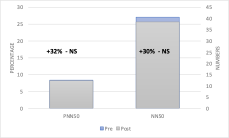
I parametri nel dominio del tempo presentano medie per la popolazione di riferimento piuttosto basse, SDNN con una media di 33ms e RMSSD di 27ms, questi dati sono coerenti in quanto il campione statistico prevedeva la valutazione di pazienti affetti da problematiche di tipo articolare e quindi in situazione di sofferenza sia acuta che cronica. I parametri hanno visto un incremento rispettivamente del 18% per l’SDNN sempre con una correlazione r0,74 e significatività p0,01 il parametro RMSSD è invece incrementato del 21% con correlazione r0,78 e significatività statistica p0,05. Va evidenziato in questi due ultimi parametri un’elevata deviazione standard pari a sd17ms per SDNN e sd19ms per RMSSD, questi valori elevati sono in relazione alla composizione del campione statistico eterogeneo per fasce d’età e per condizioni mediche di base, il dato non deve quindi sembrare strano (Fig. 2). Gli altri due parametri del dominio del tempo PNN50 e NN50 vedono un incremento rispettivamente del 32% e del 30%, entrambi con alta correlazione r0,87 e r0,86, ma nessuno dei due raggiunge la significatività statistica, rispettivamente p0,11 e p0,1 (Fig. 3).
Figura 2 e 3
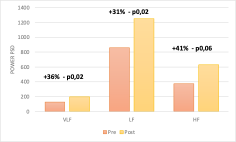
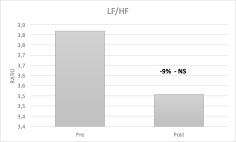
Anche i parametri relativi al dominio della frequenza hanno avuto delle modificazioni importanti, come unità di valutazione abbiamo utilizzato la PSD (power spectrum density) ricavata dal periodogramma di Welch. Nella banda delle VLF con una media di 126ms2 e un sd137ms2 abbiamo un campione di riferimento molto volatile, l’incremento è stato nel post terapia del 36% con scarsa correlazione r0,38 ma raggiungendo la significatività statistica p0,02. La frequenza LF è aumentata del 31% passando da una media di potenza di 856ms2 a 1250ms2 con correlazione r0,52 e raggiungendo anche in questo caso la significatività statistica p0,02. Le onde HF relative all’attivazione del sistema nervoso parasimpatico vedono un incremento del 41% che seppur maggiore di quello delle onde LF è correlato r0,78 ma non raggiunge la significatività statistica con p0,06 anche se non lontano (Fig 4). Interessante notare una diminuzione del 7% del rapporto LF/HF che passa da una media di 3,8 ad una di 3,5 non raggiungendo però la significatività statistica p0,57 (Fig 5).
Figura 4 e 5
Per quello che concerne i parametri non lineari abbiamo scelto le linee di identità SD1 e SD2 del grafico di Pointcarrè misurate in ms. La media dell’SD1 è di 19ms anche in questo caso con alta deviazione standard 13ms, l’incremento pre e post terapia è del 21% con r0,77 e non raggiungendo per un soffio la significatività statistica rimanendo a p0,06. La SD2 ha visto un aumento del 17%, partendo da una media maggiore (43ms) e avendo una ridotta deviazione standard rispetto a SD1 (20ms), la correlazione per SD2 si è attestata a r0,71 e ha raggiunto la significatività statistica p0,01 (Fig 6).

Figura 6
ANALISI
In questa ricerca abbiamo voluto analizzare un campione di pazienti reali, questo ha previsto un’alta eterogeneità del campione, lo si vede dai dati iniziali pre-terapia in cui sono presenti deviazioni standard molto elevate (Angelink MW. et al. 2001). I pazienti portatori di problematiche acute e croniche a livello ortopedico sono comunque soggetti che soffrono e si presentano con valori di base dell’HRV bassi. Il processo di guarigione in acuto deve presumibilmente portare ad una modifica in dei parametri relativi al carico del sistema nervoso (Huston J. Et al. 2010).
I dati analizzati presentano però degli interessanti risultati proponendo un miglioramento dei parametri dell’HRV e il conseguente beneficio indotto dalle terapie manuali utilizzate.
La bradicardia indotta dall’approccio terapeutico è un primo segnale di miglioramento del sistema nervoso centrale, è importante però non confondere la bradicardia con il miglioramento dell’HRV, non necessariamente ad una riduzione della frequenza cardiaca a riposo corrisponde un miglioramento dell’HRV.
I parametri del dominio del tempo sono tutti migliorati raggiungendo la significatività statistica nel caso delle SDNN e dell’RMSSD, questi due parametri rappresentano l’indice generale dell’efficienza del SNC, più alti sono i parametri, maggiore è la variabilità e quindi la possibilità di reagire agli stimoli (Lampert L. et al. 2008). I parametri PNN50 e NN50 mostrano dei miglioramenti anche se non significativi, confermando però il trend positivo.
C’è stato un aumento dei parametri sul dominio della frequenza con un aumento di attività a carico del sistema simpatico e parasimpatico. I valori VLF sono aumentati in modo importante, tuttavia nelle registrazioni statiche di 5 minuti questo valore di frequenza si tende a non prendere in considerazione. Le onde LF sono anch’esse aumentate in modo significativo, qui bisogna segnalare dei valori a riposo molto bassi, tipici dei soggetti patologici, un incremento di questa frequenza indica un’attivazione principalmente a carico del sistema simpatico ripristinando dei valori basali più adeguati. L’incremento delle HF anche se non significativo è caratteristico di un aumento del sistema parasimpatico che riteniamo essere funzionale ad un ripristino dell’omeostasi causato dalla terapia manuale; questi parametri sono accompagnati da una diminuzione del rapporto LF/HF, nonostante non sia stata raggiunta la significatività. Di base su questi soggetti il rapporto essendo sopra i 2 è squilibrato verso un’attivazione del sistema simpatico caratteristica dei processi legati allo stress (Sajadieh A. 2010).
Analizzando i parametri non lineari SD1 e SD2, salta subito all’occhio come ci sia una prevalenza in rilevazione dell’SD2, così come visto nel rapporto LF/HF indica uno squilibrio fra il sistema simpatico e parasimpatico. Nel post trattamento si ha un amento di entrambi parametri, con una prevalenza dell’SD1 anche se non significativa che però possiamo legare ad un miglioramento del bilanciamento del sistema nervoso.
CONCLUSIONI
L’HRV si pone come uno strumento interessante per valutare l’effetto di una terapia manuale sul sistema nervoso. E’ noto che i processi di guarigione non possono prescindere da un miglioramento del carico del sistema nervoso in risposta alle sollecitazioni indotte dalla terapia.
Questo potrebbe anche essere utilizzato come strumento per verificare se l’approccio terapeutico ha avuto in acuto un effetto positivo o negativo. La bontà di un approccio terapeutico è spesso lasciato alle sensazioni soggettive del paziente e come ogni terapia può subire un effetto placebo. Se nel lungo periodo la certezza di una terapia ortopedica è caratterizzata da un miglioramento dei test relativi per ogni articolazione, in acuto è di difficile comprensione stabilire se la terapia scelta è adeguata e puntuale.
Per facilità di rilevazione e per il costo basso degli strumenti e software necessari per analizzare ogni paziente, riteniamo l’HRV come uno strumento da inserire all’interno di un protocollo di lavoro finalizzato al miglioramento delle condizioni cliniche di ogni paziente
Saranno necessari maggiori studi per definire la bontà e i limiti di questo approccio, come ad esempio verificare per classi di età qual è la sensibilità dello screening e/o se la presenza di patologie associate e terapie farmacologiche possano modificare la modificazione dei parametri fra la fase pre e post terapeutica.
REFERENZE
Berntson, G. G., Bigger, J. T., Eckberg, D. L., Grossman, P., Kaufmann, P. G., Malik, M., et al. (1997). Heart rate variability: Origins, methods, and interpretive caveats. Psychophysiology, 34(6), 623-648.
DeBoer, R. W., Karemaker, J. M., & Strackee, J. (1987). Hemodynamic fluctuations and baroreflex sensitivity in humans: A beat-to-beat model. American Journal of Physiology—Heart and Circulatory Physiology, 253(22), H680-H689.
Goldstein, D. S., Bentho, O., Park, M. Y., & Sharabi, Y. (2011). Low frequency power of heart rate variability is not a measure of cardiac sympathetic tone but may be a measure of modulation of cardiac autonomic outflows by baroreflexes. Exp Physiol, 96(12), 1255-1261.
Karemaker, J. M. (2009). Counterpoint: Respiratory sinus arrhythmia is due to the baroreflex mechanism.Journal of Applied Psychology, 106(5), 1742–1743.
Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology (1996). Heart rate variability: Standards of measurement, physiological interpretation, and clinical Circulation, 93, 1043-1065.
Thayer, J. F., Ahs, F., Fredrikson, M., Sollers, J. J., & Wager, T. D. (2012). A meta-analysis of heart rate variability and neuroimaging studies: Implications for heart rate variability as a marker of stress and health. Neuroscience and Biobehavioral Reviews, 36, 747-756.
Thayer, J. F., Yamamoto, S. S., & Brosschot, J. F. (2010). The relationship of autonomic imbalance, heart rate variability and cardiovascular disease risk factors. Int J Cardiol, 141(2), 122-131.
Elgendi, Mohamed. “On the Analysis of Fingertip Photoplethysmogram Signals.” CCR Current Cardiology Reviews 8.1 (2012): 14-25. Web.
Malik, M., J. T. Bigger, A. J. Camm, R. E. Kleiger, A. Malliani, A. J. Moss, and P. J. Schwartz. “Heart Rate Variability: Standards of Measurement, Physiological Interpretation, and Clinical Use.” European Heart Journal 17.3 (1996): 354-81. Web.
Beckers, F., Ramaekers, D., & Aubert, A. E. (2001). Approximate entropy of heart rate variability: Validation of methods and application in heart failure. Cardiovascular Engineering: An International Journal, 1(4), 177-182.
Berntson, G. G., Quigley, K. S., & Lozano, D. (2007). Cardiovascular psychophysiology. In J. T. Cacioppo, L. G. Tassinary, & G. G. Berntson (Eds.). Handbook of psychophysiology (3rd ed.). New York: Cambridge University Press.
Bigger, J., Fleiss, J., Steinman, R., Rolnitzky, L., Kleiger, R., & Rottman, J. (1992). Frequency domain measures of heart period variability and mortality after myocardial infarction. Circulation, 85, 164-171.
Combatalade, D. (2009). Basics of heart rate variability applied to psychophysiology. Montreal, Canada: Thought Technology Ltd.
DeGiorgio, C. M., Miller, P., Meymandi, S., Chin, A., Epps, J., Gordon, S., Gombein, J., & Harper, R. M. (2010). RMSSD, a measure of vagus-mediated heart rate variability, is associated with risk factors for SUDEP: The SUDEP-7 Inventory. Epilepsy Behav, 19(1), 78-81.
Rahman, F., Pechnik, S., Gross, D., Sewell, L., & Goldstein, D. S. (2011). Low frequency power of heart rate variability reflects baroreflex function, not cardiac sympathetic innervation. Clinical Autonomic Research Clin Auton Res, 21(3), 133-141. doi:10.1007/s10286-010-0098-y
Kleiger, R. E., Miller, J. P., Bigger, J. T., Moss, A. J., & the Multicenter Post-Infarction Research Group (1987). Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. American Journal of Cardiology, 59(4), 256-262.
Lampert, R., Bremner, J. D., Su, S., Miller, A., Lee, F., Cheema, F., . . . Vaccarino, V. (2008). Decreased heart rate variability is associated with higher levels of inflammation in middle-aged men. American Heart Journal, 156(4). doi:10.1016/j.ahj.2008.07.009
Lippman, N., Stein, K. M., & Lerman, B. B. (1994). Comparison of methods for removal of ectopy in measurement of heart rate variability. Am J Physiol, 267(1 Pt 2), H411-H4118.
Acharya, U., et al. “Heart Rate Variability: A Review.” Medical & Biological Engineering & Computing Med Bio Eng Comput 44.12 (2006): 1031-051.
Carter, James B., Eric W. Banister, and Andrew P. Blaber. “Effect of Endurance Exercise on Autonomic Control of Heart Rate.” Sports Medicine 33.1 (2003): 33-46.
Franco, Oscar H. “Effects of Physical Activity on Life Expectancy With Cardiovascular Disease.”Arch Intern Med Archives of Internal Medicine 165.20 (2005): 2355.
Huston, J. M., and K. J. Tracey. “The Pulse of Inflammation: Heart Rate Variability, the Cholinergic Anti-inflammatory Pathway and Implications for Therapy.” Journal of Internal Medicine 269.1 (2010): 45-53.
Jonker, J. T. “Physical Activity and Life Expectancy With and Without Diabetes: Life Table Analysis of the Framingham Heart Study.” Diabetes Care 29.1 (2006): 38-43. Web.
Liao, Duanping, et al. “Association of Vagal Tone with Serum Insulin, Glucose, and Diabetes Mellitus — The ARIC Study.” Diabetes Research and Clinical Practice30.3 (1995): 211-21.
Mouton, Charlotte, et al. “The Relationship between Heart Rate Variability and Time-course of Carcinoembryonic Antigen in Colorectal Cancer.” Autonomic Neuroscience 166.1-2 (2012): 96-99.
Reimers, C. D., G. Knapp, and A. K. Reimers. “Does Physical Activity Increase Life Expectancy? A Review of the Literature.” Journal of Aging Research 2012 (2012): 1-9.
Sajadieh, A. “Increased Heart Rate and Reduced Heart-rate Variability Are Associated with Subclinical Inflammation in Middle-aged and Elderly Subjects with No Apparent Heart Disease.” European Heart Journal 25.5 (2004): 363-70.
Schroeder, E. B., et al. “Diabetes, Glucose, Insulin, and Heart Rate Variability: The Atherosclerosis Risk in Communities (ARIC) Study.” Diabetes Care 28.3 (2005): 668-74.










Commenti